Chapter 1
1.Pengukuran massa dan volume dari tiga benda padat terdapat pada tabel berikut.
Diketahui hal dalam tabel.
ρ1=2/2
ρ1=1gr/cm³
ρ2=2/5
ρ2=0,4gr/cm³
ρ3=4/1,5
ρ3=2,6gr/cm³
ρ1 setara dengan ρ air (melayang);
ρ2 lebih kecil dari ρ air (mengapung);
ρ3 lebih besar dari ρ air (tenggelam).
A. Siswa A dan B
B. Siswa B dan C
C. Siswa B dan D
D. Siswa C dan D
A. (26 , 26) : (88 , 88)
B. (26 , 26) : (88 , 138)
C. (26 , 30) : (88 , 138)
D. (26 , 30) : (88 , 266)
E. (26 , 56) : (88 , 138)
Pembahasan
Pada isotop unsur dan
jumlah proton dan neutron kedua unsur secara berturut turut adalah:
Proton = 26
Elektron = 26
Neutron = 30
Proton = 88
Elektron = 88
Neutron = 138
2.Unsur X mempunyai 10 proton dan 12 neutron, sedangkan unsur Y mempunyai nomor massa 23 dan nomor atom 11. Kedua atom tersebut merupakan . . . .
A. Isotop
B. Isobar
C. Isoton
D. Isokhor
E. Isomer
Kedua atom tersebut merupakan isoton. Keduanya memiliki jumlah neutron yanag sama yaitu 12. Adapun proton dan elektronnya berbeda.
Pembahasan
Atom dalam penulisannya pada tabel periodic dilengkapi dengan dua data pendukung yaitu nomor massa dan nomor atom. Nomor atom merupakan angka yang melambangkan jumlah proton atau elektron yang terletak pada suatu atom. Adapun nomor massa merupakan angka yang melambangkan total dari proton dan neutron.
1. Isotop
Isotop adalah dua unsur atau lebih yang memiliki nomor atom sama tetapi nomor massa berbeda. Isotop-isotop unsur dapat digunakan untuk menentukan massa atom relatif atom tersebut. Contoh: ¹³₆C dan ¹²₆C.
2. Isobar
Isobar adalah dua unsur atau lebih yang memiliki nomor massa sama tetapi nomor atom berbeda. Contoh: ¹³₆C dengan ¹³₇N.
3. Isoton
Isoton duan unsur atau lebih yang memiliki jumlah neutron sama. Contoh: ¹⁴₈O dengan ¹⁵₇N.
Chapter 3
a. 30 detik
b. 20 detik
c. 15 detik
d. 10 detik
e. 5 detik
Pembahasan
t2 = t1 (1/n)^delta T/T○
= 40 (1/2)^50-30/10
= 40 (1/2)^2
= 40 (1/4)
= 10 detik
2.Berdasarkan eksperimen pada reaksi berikut.
H2O2(aq) + 2HI(aq) → 2H2O(l) + I2(aq)
Diketahui bahwa konsentrasi I2 bertambah dari 0 menjadi 0,002 mol/L dalam waktu 10 sekon. Berapakah laju reaksi pembentukan I2…
a. 1 x 10-3
b. 1 x 10-4
c. 1 x 10-5
d. 2 x 10-3
e. 2 x 10-4
Pembahasan
v = ΔM/Δt = 0,002 M / 10 s = 2.10⁻⁴ M/s
Chapter 5
1.Tidak ada zat yang hilang akibat terjadinya reaksi kimia, yang ada hanya berubah menjadi bentuk zat lain. Pernyataan ini ditemukan pertama kali oleh….
a. Antoine Lavoiser
b. Joseph Proust
c. John Dalton
d. Joseph Louis Gay-Lussac
e. Amadeo Avogadro
a. 25,26 gr
b. 20,48 gr
c. 18,63 gr
d. 16,52 gr
e. 12,32 gr
Pembahasan
P = 110 cmHg
P = 1,4473684210526315789473684210526
P = 1,45 atm
T = 25 + 273
T = 298 K
PV = nRT
1,45 x 10 = n x 0,082 x 298
n = 0,5933868063512849893599607137011
n = 0,59 mol
Mr N₂ = 2. Ar N
Mr N₂ = 2. 14
Mr N₂ = 28
massa N₂ = n x Mr
massa N₂ = 0,59 x 28
massa N₂ = 16,52 gram
*hasil akan berbeda tergantung dari pembulatan angka pada pembagian
Chapter 6
1.Sebuah Kristal KNO3 dimasukkan ke dalam tabung reaksi kemudian ditetesi dengan air. Pada tabung reaksi terasa dingin. Reaksi ini dapat digolongkan….
a. Eksoterm, energi berpindah dari sistem ke lingkungan
b. Eksoterm, energi berpindah dari lingkungan kesistem
c.Endoterm,energi berpindah dari sistem ke lingkungan
d.Endoterm, energi berpindah dari lingkungan kesistem
e.Endoterm,energi tak berpindah
Sebuah kristal KNO3 dimasukkan ke dalam tabung reaksi, kemudian ditetesi dengan air. Pada dasar tabung reaksi terasa dingin. Reaksi ini dapat digolongkan Reaksi endoterm.
Pembahasan
Sistem dan Lingkungan
Reaksi Eksoterm
Jika reaksi berlangsung dengan melepaskan/menghasilakan kalor dari sistem ke lingkungan maka reaksi disebut reaksi eksotem. Pelepasan kalor yang terjadi menyebabkan penurunan entalpi reaksi sehingga ΔH reaktan > ΔH produk, maka ΔH bertanda negatif.
Reaksi Endoterm
Jika reaksi berlangsung dengan menyerap/membutuhkan kalor dari lingkungan ke sistem maka reaksi disebut endoterm. Penyerapan kalor oleh sistem menyebabkan kenaikan entalpi reaksi sehingga ΔH produk > ΔH reaktan, maka ΔH bertanda positif.
Jawab
Dari penjelasan diatas, bahwa reaksi endoterm berlangsung dengan meyerap kalor. Oleh karena itu, terjadi perpindahan kalor dari lingkungan ke sistem sehingga suhu lingkungan turun dan suhu siste menjadi naik, hal ini menyebabkan lingkungan menjadi lebih dingin.
Ketika kristal KNO3 dimasukkan ke dalam tabung reaksi, kemudian ditetesi dengan air. Pada dasar tabung reaksi terasa dingin, maka termasuk reaksi endoterm.
Jika reaksi yang berlangsung eksoterm terjadi pelepasan kalor dari sistem ke lingkungan sehingga lingkungan menjadi lebih panas dari pada sistem. Maka ketika reaksi sedang berlangsung lingkungan akan terasa panas.
2.Jika diketahui ΔHc°C = -393,5 kJ mol‾¹ , berapa kalor yang terjadi pada pembakaran 1 kg arang, jika dianggap bahwa arang mengandung 48% karbon dan Ar C = 12?
a. 15.740 kJ
b. 16.470 kJ
c. 16.740 kJ
d. 15.470 kJ
e. 17.740 kJ
Jawaban:
Kalor yang dihasilkan pada pembakaran 1 kg arang (45% Karbon) sebesar .... kJ
Penjelasan:
Jika diketahui ΔH°c C = - 393,5 kJ/mol
Pada pembakaran 1 kg arang, maka massa karbon =
massa arang = 1 kg = 1.000 gram
massa C = × massa arang
= × 1.000 gram
= 480 gram
mol C =
=
= 40 mol
Maka besarnya kalor untuk 40 mol karbon yang dibakar =
q = - ΔH × mol
= - (- 393,5 kJ/mol) × 40 mol
= 15.740 kJ
Chapter 7
A. 4
B. 5
C. 6
D. 9
E. 10
Jawaban:
6
Penjelasan:
pada atom 22Ti konfigurasi elektronnya
1s2 2s2 2p6 3s2 3p6 4s2 3d2
pada kulit ke 3 terdapat
3s2 3p6 dan 3d2
pada 3s2 orbital yg terisi ada 1
pada 3p6 orbital yg terisi ada 3
pada 3d2 orbital yg terisi ada 2
sehingga jumlah orbital yg ada pada 22Ti adalah
1 + 3 + 2 = 6
n = 4, l = 1, m = 0 , s = -1/2
Nomor atom unsur X tersebut adalah . . . .
A. 20
B. 25
C. 30
D. 35
E. 36
Unsur x memiliki nomor atom 25
25X = 2 . 8. 8. 1 ⇒ 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 4p⁶
elektron terakhir berada pada 4s¹, maka keempat bilangan kuantum elektron terakhir tersebut adalah
n = 4, l = 1, m = 0, dan s = -½
Chapter 8
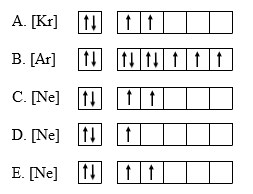
Jawab :
Diketahui sebuah unsur memiliki notasi ²⁷X₁₃ . Diagram orbital yg paling tepat untuk elektron terakhir dari unsur x adalah ₁₃X = [Ne] ⇅ ↑ (D)
Penyelesaian soal :
Diketahui : ₁₃X
Ditanya : diagram orbital X = ...?
Jawab :
₁₃X = 1s² 2s² 2p⁶ 3s² 3p¹
⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ↑
₁₃X = [Ne] 3s² 3p¹
₁₃X = [Ne] ⇅ ↑
⇒ Kesimpulan, Diketahui sebuah unsur memiliki notasi ²⁷X₁₃ . Diagram orbital yg paling tepat untuk elektron terakhir dari unsur x adalah ₁₃X = [Ne] ⇅ ↑ (D).
Pembahasan :
KONFIGURASI ELEKTRON
Ada 3 aturan penulisan konfigurasi elektron :
1. Aturan Aufbau
Aufbau berprinsip bahwa pengisian elektron pada orbital dimulai dari tingkat energi terendah ke tingkat energi lebih tinggi.
Urutan pengisian berdasarkan tingkat energi :
1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ 5s² 4d¹⁰ 5p⁶ 6s² 4f¹⁴ 5d¹⁰ 6p⁶ 7s² 5f¹⁴ 6d¹⁰ 7p⁶
Contoh :
Konfigurasi elektron :
₃Li = 1s² 2s¹
₁₁Na = 1s² 2s² 2p⁶ 3s¹
₂₁Sc : 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹
2. Aturan Hund
Yaitu pengisian elektron pada orbital-orbital yang tingkat energinya sama elektron tidak berpasangan sebelum orbital-orbital lainnya masing-masing terisi satu elektron.
Asas ini dikemukakan berdasarkan penalaran bahwa energi tolak-menolak antara dua elektron akan minimum jika jarak antara elektron berjauhan.
Contoh :
Tentukan diagram orbital untuk unsur-unsur berikut :
₇N = 1s² 2s² 2p³
⇅ ⇅ ↑ ↑ ↑
₉F = 1s² 2s² 2p⁵
⇅ ⇅ ⇅ ⇅ ↑
3. Larangan Pauli
Pauli mengemukakan hipotesisnya yang menyatakan bahwa dalam satu atom tidak mungkin dua elektron mempunyai keempat bilangan kuantum sama. Misal, 2 elektron akan menempati subkulit 1s. Tiga bilangan kuantum pertama akan mempunyai nilai yang sama (n = 1, l = 0, m = 0). Untuk itu bilangan kuantum yang terakhir, yaitu bilangan kuantum spin (s) harus mempunyai nilai berbeda (+½ atau -½) . Dengan kata lain, setiap orbital maksimal hanya dapat terisi 2 elektron dengan arah spin berlawanan.
Jumlah elektron maksimal untuk tiap subkulit sama dengan dua kali dari jumlah orbitalnya.
- orbital s maksimal 2 elektron,
- orbital p maksimal 6 elektron,
- orbital d maksimal 10 elektron, dan
- orbital f maksimal 14 elektron.
Contoh :
Tentukan harga keempat bilangan kuantum pada elektron terakhir 2s¹.
2s¹ → n = 2 ; l = 0 ; m = 0 ; s = +½
Tentukan harga keempat bilangan kuantum pada :
₂₀Ca = 1s² 2s² 2p⁶ 3s² 3p⁶ 4s²
4s² → n = 4 ; l = 0 ; m = 0 ; s = -½
2.Konfigurasi elektron dari unsur X adalah
![]()
Unsur tersebut terletak pada…
A. golongan IIIA periode 5
B. golongan VA periode 5
C. golongan VA periode 3
D. golongan IIIA periode 4
E. golongan VIA periode 5
Jawab
![]()
Periode 5 Golongan VA
Pembahasan
Aturan Aufbau
Aufbau berprinsip bahwa pengisian elektron pada orbital dimulai dari tingkat energi terendah ke tingkat energi lebih tinggi.
Urutan pengisian berdasarkan tingkat energi :
1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ 5s² 4d¹⁰ 5p⁶ 6s² 4f¹⁴ 5d¹⁰ 6p⁶ 7s² 5f¹⁴ 6d¹⁰ 7p⁶
Contoh :
Konfigurasi elektron :
₃Li = 1s² 2s¹
₁₁Na = 1s² 2s² 2p⁶ 3s¹
₂₁Sc : 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹
Chapter 9
2.Berikut ini beberapa senyawa kovalen:
- CH4
- NH3
- PCl5
- PCl3
- CO2
(Nomor atom: C = 6; H = 1; N = 7; P = 15; Cl = 17; dan O = 8). Senyawa kovalen yang mengalami penyimpangan kaidah oktet dalam struktur Lewisnya adalah ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Chapter 10
A. segitiga datar
B. segiempat planar
C. tetrahedron
D. bentuk T
E. bentuk V
2.Pasangan yang tidak mungkin terjadi antara bentuk hibridisasi dan bentuk molekul suatu senyawa adalah ….
A. sp – linear
B. sp3 – linear
C. sp3 – bentuk bengkok
D. sp3 – tetrahedral
E. sp3 – trigonal bipiramida
Chapter 11
A. 0,83 x 10²³ partikel
B. 0,72 x 10²³ partikel
C. 0,42 x 10²³ partikel
D. 0,22 x 10²³ partikel
E. 0,12 x 10²³ partikel
Chapter 11
- (1) Reaksi redoks
- (2) Busur bredig
- (3) Reaksi hidrolisis
- (4) Peptiasi
- (5) Reaksi pemindahan
- (6) Mekanik
Pembuatan koloid secara disperse adalah …
a. 1, 2, dan 3
b. 1, 3, dan 4
c. 2, 3, dan 4
d. 2, 4, dan 6
e. 4, 5, dan 6
2.Koloid dapat menyerap ion pada permukaannya. Sifat ini disebut …
a. Elektroforesis
b. Absorbsi
c. Adsorpsi
d. Dialisis
e. Elektroforesis
Chapter 12
a. 0,943
b. 0,957
c. 0,987
d. 0,945
e. 0,975
2.Tekanan uap pada temperatur 30 adalah 55.30 mmHg. Maka penurunan tekanan uap, jika kedalam 108 gram air dilarutkan 36 gram glukosa Jika (Ar C=12, H=1, O=16) adalah ….
a. 66 mmHg
b. 33 mmHg
c. 45 mmHg
d. 48 mmHg
e. 56 mmHg



No comments:
Post a Comment