Latihan dan Kuis 6 Example dan problem 13-18
EXAMPLE Chapter 13
konstanta laju reaksi orde pertama adalah 4,6 × 10-⁴ s-¹ pada 350 ° c. jika energi aktivasi adalah 104 kj / mol, hitung suhu di mana laju konstannya adalah 8,80 × 10-⁴ s-¹!
Suhu di mana konstanta lajunya adalah 371°C. Reaksi berlangsung pada orde atau tingkat pertama. Perhitungan diselesaikan menggunakan persamaan Arrhenius yang telah diolah.
Pembahasan
Persamaan Arrhenius yang telah diolah adalah sebagai berikut:
Keterangan
- k₁ = konstanta laju reaksi pada suhu T₁
- k₂ = konstanta laju reaksi pada suhu T₂
- Ea = energi aktivasi
- R = tetapan gas
Diketahui
Reaksi berlangsung pada orde atau tingkat pertama
Konstanta laju reaksi k₁ = pada suhu T₁
Konstanta laju reaksi k₂ = pada suhu T₂
T₁ = 350°C ⇒ T₁ = 350 + 273 = 623 K
Energi aktivasi Ea = 104 kJ/mol = 104.000 J/mol
Tetapan gas R = 8,314 J/mol.K
Ditanya
Suhu T₂
Pengerjaan
Substitusikan data-data ke dalam persamaan
EXAMPLE 15
15.11
Asam oksalat (H2C2O4) adalah zat beracun yang digunakan terutama sebagai pemutih dan pembersihan agen (misalnya, untuk melepas cincin bak mandi). Hitung konsentrasi semua spesies hadir pada kesetimbangan dalam larutan 0,10 M.
Strategi :
Menentukan konsentrasi kesetimbangan spesies asam diprotic dalam larutan air lebih banyak terlibat daripada asam monoprotik. Kami mengikuti hal yang sama prosedur seperti yang digunakan untuk asam monoprotik untuk setiap tahap. Catatan bahwa basa konjugasi dari tahap pertama ionisasi menjadi asam untuk ionisasi tahap kedua.
Solusi :
Langkah 1: Spesies utama dalam larutan pada tahap ini adalah asam tak terionisasi, ion H1, dan basis konjugasi, HC2O24.
Langkah 2: Membiarkan x menjadi konsentrasi kesetimbangan H1 dan HC2O24 ion dalam mol / L, kita meringkasnya :
Langkah 3: Tabel 15.5 memberi kita
Jelas perkiraannya tidak valid. Oleh karena itu, kita harus menyelesaikan kuadrat persamaan
Hasilnya adalah x 5 0,054 M.
Langkah 4: Ketika kesetimbangan untuk tahap pertama ionisasi tercapai, konsentrasi adalah
Selanjutnya kita perhatikan tahap kedua ionisasi.
Langkah 1: Pada tahap ini, spesies utama adalah HC2O24, yang bertindak sebagai asam di detik tahap ionisasi, H1, dan basa konjugasi C2O4 22.
Langkah 2: Misalkan y adalah konsentrasi kesetimbangan ion H1 dan C2O4 22 dalam mol / L, kita meringkaskan:
Langkah 3: Tabel 15.5 memberi kita
Langkah 4: Pada kesetimbangan,
Dengan menggunakan daftar potensial elektrode standar, tentukan potensial sel Volta berikut
A. Zn (s) + Cu²⁺ (2 M) → Zn²⁺ (1 M) + Cu(s)
B. 2Ag⁺ (1 M) + Mg (s) → 2Ag (s) + Mg²⁺ (0,001 M)
Tentukan potensial sel dengan konsentrasi berikut :
A. Cu | Cu²⁺ (0.001 M) || Cu²⁺ (1 M) | Cu
B. Zn | Zn²⁺ (0.1 M) || Zn²⁺ (0.001 M) | Zn
Pembahasan
Penentuan nilai potensial sel pada sel volta digunakan persamaan
E° sel = E° katoda - E° anoda
E° sel = E° reduksi - E° oksidasi
Jika digambarkan dalam notasi sel (Anoda || Katoda) maka digunakan :
E° sel = E° kanan - E° kiri.
Pada pasangan sel :
A. Zn (s) + Cu²⁺ (2 M) → Zn²⁺ (1 M) + Cu(s)
- Logam yang mengalami reduksi : Cu
- Logam yang mengalami oksidasi : Zn
- E° sel = E° katoda - E° anoda
= E° Cu²⁺ | Cu - E° Zn²⁺ | Zn
B. 2Ag⁺ (1 M) + Mg (s) → 2Ag (s) + Mg²⁺ (0,001 M)
- Logam yang mengalami reduksi : Ag
- Logam yang mengalami oksidasi : Mg
- E° sel = E° katoda - E° anoda
= E° Ag⁺ | Ag - E° Mg²⁺ | Mg
Elektrokimia adalah bagian dari ilmu kimia yang mempelajari hubungan antra perubahan zat dan arus listrik di dalam sel. Sel elektrokimia merupakan suatu sel yang terdiri dari dua elektrode dan larutan elektrolit. Sel elektrokimia terdiri dari dua macam sel yaitu sel volta dan sel elektrolisis.
Sel volta atau sel galvani mempunyai elektroda logam yang dicelupkan ke dalam larutan elektrolit. Prinsip yang bekerja di dalam sel volta adalah reaksi redoks spontan untuk menghasilkan arus listrik. Untuk menentukan letak elektroda dalam sel volta digunakan data potensial reduksi standar (E° sel) dari masing-masing logam yang digunakan.
Pb²⁺ (aq) + 2e⁻ ⇄ Pb (s) E° = - 0,13 V
Zn²⁺ (aq) + 2e⁻ ⇄ Zn (s) E° = - 0,76 V
a. Untuk menentukan letak logam pada elektroda dengan memilih E° sel logam yang lebih besar sebagai katoda, dan logam dengan E° sel lebih kecil digunakan sebagai anoda. Elektrolit yang digunakan dalam setiap sel adalah larutan yang mengandung ion dari logam elektrodenya. Sehingga diperoleh:
- Anoda : Zn (dalam gambar biasanya dituliskan pada setengah sel kiri)
- Katoda : Pb (dalam gambar biasanya dituliskan pada setengah sel kanan)
- Muatan Anoda : (-) atau negatif
- Muatan Katoda : (+) atau positif
- Elektrolit pada setengah sel anoda : Larutan yang berada pada gelas beaker elektroda Zn (ZnSO₄)
- Elektrolit pada setengah sel anoda : Larutan yang berada pada gelas beaker elektroda Pb (PbSO₄)
- Arah aliran elektron dalam kawat dari anoda (kutub negatif) menuju katoda (kutub positif)
- Arah aliran elektron dalam larutan dari elektrolit menuju jembatan garam dan diteruskan menuju setengah sel lainnya
- Elektrolit jembatan garam : KNO₃. Ion K⁺ menuju setengah sel anoda, ion NO₃⁻ menuju setengah sel katoda
- Reaksi Anoda (oksidasi) : Zn (s) ⇄ Zn²⁺ (aq) + 2e⁻
- Reaksi Katoda (reduksi) : Pb²⁺ (aq) + 2e⁻ ⇄ Pb (s)
- Reaksi Sel (redoks) : Zn (s) + Pb²⁺ (aq) ⇄ Zn²⁺ (aq) + Pb (s)
- Notasi sel : Anoda ║Katoda
Notasi sel : Zn (s) Ι Zn²⁺ (aq) ║Pb²⁺ (aq) Ι Pb (s)
Problem 13
Mol Na2CO3 = 0,01 x 0,1 = 0,001 mol
Massa Na2CO3 = mol Na2CO3 x Mr
Massa Na2CO3 = 0,001 x 106 = 0,106 gr
Dengan menggunakan daftar potensial elektrode standar, tentukan potensial sel Volta berikut
A. Zn (s) + Cu²⁺ (2 M) → Zn²⁺ (1 M) + Cu(s)
B. 2Ag⁺ (1 M) + Mg (s) → 2Ag (s) + Mg²⁺ (0,001 M)
Tentukan potensial sel dengan konsentrasi berikut :
A. Cu | Cu²⁺ (0.001 M) || Cu²⁺ (1 M) | Cu
B. Zn | Zn²⁺ (0.1 M) || Zn²⁺ (0.001 M) | Zn
Pembahasan
Penentuan nilai potensial sel pada sel volta digunakan persamaan
E° sel = E° katoda - E° anoda
E° sel = E° reduksi - E° oksidasi
Jika digambarkan dalam notasi sel (Anoda || Katoda) maka digunakan :
E° sel = E° kanan - E° kiri.
Pada pasangan sel :
A. Zn (s) + Cu²⁺ (2 M) → Zn²⁺ (1 M) + Cu(s)
- Logam yang mengalami reduksi : Cu
- Logam yang mengalami oksidasi : Zn
- E° sel = E° katoda - E° anoda
= E° Cu²⁺ | Cu - E° Zn²⁺ | Zn
B. 2Ag⁺ (1 M) + Mg (s) → 2Ag (s) + Mg²⁺ (0,001 M)
- Logam yang mengalami reduksi : Ag
- Logam yang mengalami oksidasi : Mg
- E° sel = E° katoda - E° anoda
= E° Ag⁺ | Ag - E° Mg²⁺ | Mg
Elektrokimia adalah bagian dari ilmu kimia yang mempelajari hubungan antra perubahan zat dan arus listrik di dalam sel. Sel elektrokimia merupakan suatu sel yang terdiri dari dua elektrode dan larutan elektrolit. Sel elektrokimia terdiri dari dua macam sel yaitu sel volta dan sel elektrolisis.
Sel volta atau sel galvani mempunyai elektroda logam yang dicelupkan ke dalam larutan elektrolit. Prinsip yang bekerja di dalam sel volta adalah reaksi redoks spontan untuk menghasilkan arus listrik. Untuk menentukan letak elektroda dalam sel volta digunakan data potensial reduksi standar (E° sel) dari masing-masing logam yang digunakan.
Pb²⁺ (aq) + 2e⁻ ⇄ Pb (s) E° = - 0,13 V
Zn²⁺ (aq) + 2e⁻ ⇄ Zn (s) E° = - 0,76 V
a. Untuk menentukan letak logam pada elektroda dengan memilih E° sel logam yang lebih besar sebagai katoda, dan logam dengan E° sel lebih kecil digunakan sebagai anoda. Elektrolit yang digunakan dalam setiap sel adalah larutan yang mengandung ion dari logam elektrodenya. Sehingga diperoleh:
- Anoda : Zn (dalam gambar biasanya dituliskan pada setengah sel kiri)
- Katoda : Pb (dalam gambar biasanya dituliskan pada setengah sel kanan)
- Muatan Anoda : (-) atau negatif
- Muatan Katoda : (+) atau positif
- Elektrolit pada setengah sel anoda : Larutan yang berada pada gelas beaker elektroda Zn (ZnSO₄)
- Elektrolit pada setengah sel anoda : Larutan yang berada pada gelas beaker elektroda Pb (PbSO₄)
- Arah aliran elektron dalam kawat dari anoda (kutub negatif) menuju katoda (kutub positif)
- Arah aliran elektron dalam larutan dari elektrolit menuju jembatan garam dan diteruskan menuju setengah sel lainnya
- Elektrolit jembatan garam : KNO₃. Ion K⁺ menuju setengah sel anoda, ion NO₃⁻ menuju setengah sel katoda
- Reaksi Anoda (oksidasi) : Zn (s) ⇄ Zn²⁺ (aq) + 2e⁻
- Reaksi Katoda (reduksi) : Pb²⁺ (aq) + 2e⁻ ⇄ Pb (s)
- Reaksi Sel (redoks) : Zn (s) + Pb²⁺ (aq) ⇄ Zn²⁺ (aq) + Pb (s)
- Notasi sel : Anoda ║Katoda
Notasi sel : Zn (s) Ι Zn²⁺ (aq) ║Pb²⁺ (aq) Ι Pb (s)




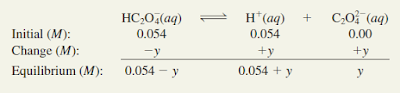




No comments:
Post a Comment